Введение
Некачественные и контрафактные лекарственные средства — глобальная проблема здравоохранения, затрагивающая все регионы мира1,2.

Некачественные и поддельные лекарства могут встречаться во всех терапевтических категориях — от дешевых обезболивающих до крайне дорогостоящих противораковых средств2. Нередко контрафактные и некондиционные медицинские продукты содержат токсичные и ядовитые вещества, становясь прямой причиной осложнений и даже смерти людей4.
Для того, чтобы гарантировать качество лекарственных средств и таким образом защитить потребителя от контрафактных медицинских препаратов, Всемирная организация здравоохранения и Европейское агентство по лекарственным средствам разработали стандарт GDP (Good Distributional Practice, Надлежащая дистрибьюторская практика). Первая редакция стандарта была опубликована ещё в 1994 году)5,6,7.

Как обеспечивается качество медицинских продуктов
Стандарт GDP описывает минимальные требования к оптовым дистрибьютерам медицинских продуктов и их деятельности, чтобы гарантировать:

Сохранение качества и подлинности лекарственных средств

Безопасность и эффективность активных фармацевтических субстанций

Безопасность другого сырья, используемого для производства лекарств

Надлежащие условия хранения и транспортировки медицинских продуктов на всём протяжении цепи поставок, от исходного сырья до реализации конечному пользователю.
Наряду с другим важнейшим стандартом GMP (Good Manufacturing Practice, Надлежащая производственная практика), стандарт GDP — это основа системы менеджмента качества медицинских продуктов, защищающей конечного потребителя от некачественных и поддельных лекарств6,8.
Нарушения требований стандарта GDP и их последствия для потребителя
Зимой 2022 года обычный безрецептурный сироп от кашля привел к гибели 21 ребёнка в Узбекистане. Причиной трагедии стали смертельные дозы этиленгликоля и диэтиленгликоля, попавшие в лекарство. Плохой контроль качества и халатное отношение к обязательным испытаниям импортируемых в страну лекарственных средств привели к попаданию опасного препарата в розничную сеть9,10.
Подобные случаи регистрируются каждый год по всему миру11. Строгая приверженность стандарту делает невозможными такие инциденты, так как надлежащая дистрибьютерская практика гарантирует не только высокое качество исходного сырья, но также исключает вероятность загрязнения лекарственных средств посторонними веществами6.
Как стандарт GDP обеспечивает высокое качество продуктов компании «Джонсон & Джонсон»?

В качестве примера завода, который работает по стандартам GDP, можно привести производство микроклизм Микролакс® «Джонсон & Джонсон» в Орлеане (Франция) на заводе АО «Делфарм».
Продукты корпорации «Джонсон & Джонсон» отличаются своей безопасностью благодаря системе менеджмента качества, которая считается одной из самых строгих в индустрии. Все ингредиенты и продукция проходят строгий 5-уровневый процесс обеспечения безопасности, который включает12:

1 Подбор безопасного и качественного сырья.

2 Оценка всех компонентов будущего лекарственного сырья на токсичность.

3 Клиническая оценка и клинические испытания продуктов.

4 Испытания на безопасность и стабильность в реальных условиях.

5 Непрекращающийся пострегистрационный надзор за каждым продуктом компании.
Выводы
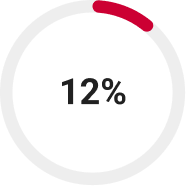
доля фальсифицированной фармацевтической продукции от всего рынка в России cогласно недавним исследованиям13.

Подобные подделки причиняют прямой и косвенный вред здоровью, ведут к утрате доверия системе здравоохранения и значительным финансовым издержкам2,4.

Стандарт GDP — это единственный эффективный способ борьбы с некачественными и контрафактными лекарственными средствами. Приверженность производителей и дистрибьютеров лекарственных средств стандарту GDP не только гарантирует подлинность и безопасность медицинских продуктов, но также способствует повышению доверия потребителей к компаниям и их продукции.
Ссылки
Каждый десятый продукт медицинского назначения в развивающихся странах является некондиционным или фальсифицированным. Всемирная организация здравоохранения. Доступно по ссылке: https://www.who.int/ru/news/item/28-11-2017-1-in-10-medical-products-in-developing-countries-is-substandard-or-falsified Дата обращения 17.04.2023.
Некондиционная и фальсифицированная медицинская продукция. Всемирная организация здравоохранения. Доступно по ссылке: https://www.who.int/ru/news-room/fact-sheets/detail/substandard-and-falsified-medical-products Дата обращения 17.04.2023.
World Health Organization. (2017). A study on the public health and socioeconomic impact of substandard and falsified medical products. World Health Organization. Доступно по ссылке: https://apps.who.int/iris/handle/10665/331690 . Дата обращения 17.04.2023.
Countering the Problem of Falsified and Substandard Drugs. Gillian J. Buckley and Lawrence O. Gostin, Editors; Committee on Understanding the Global Public Health Implications of Substandard, Falsified, and Counterfeit Medical Products; Board on Global Health; Institute of Medicine. ISBN 978-0-309-26939-1.
Good storage and distribution practices for medical products. WHO Technical Report Series, №. 1025. Доступно по ссылке: https://www.who.int/publications/m/item/trs-1025-annex-7 Дата обращения 17.04.2023.
Good distribution practice. European Medicines Agency. Доступно по ссылке: https://www.ema.europa.eu/en/human-regulatory/post-authorisation/compliance/good-distribution-practice Дата обращения 17.04.2023.
Guidelines of 5 November 2013 on Good Distribution Practice of medicinal products for human use. European Medicines Agency. (по состоянию на 17 апреля 2023 года). Доступно по ссылке: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:C:2013:343:0001:0014:EN:PDF Дата обращения 17.04.2023.
Good manufacturing practice. European Medicines Agency. Доступно по ссылке: https://www.ema.europa.eu/en/human-regulatory/research-development/compliance/good-manufacturing-practice Дата обращения 17.04.2023.
Uzbekistan cough syrup scandal. Доступно по ссылке: https://en.wikipedia.org/wiki/Uzbekistan_cough_syrup_scandal Дата обращения 17.04.2023.
Medical Product Alert N°1/2023: Substandard (contaminated) liquid dosage medicines Доступно по ссылке:
https://www.who.int/news/item/11-01-2023-medical-product-alert-n-1-2023-substandard-(contaminated)-liquid-dosage-medicines Дата обращения 17.04.2023.
WHO urges action to protect children from contaminated medicines. Доступно по ссылке: https://www.who.int/news/item/23-01-2023-who-urges-action-to-protect-children-from-contaminated-medicines Дата обращения 17.04.2023.
Наши стандарты безопасности. Johnson & Johnson. Доступно по ссылке: https://www.johnsonsbaby.ru/safety-standards Дата обращения 17.04.2023.
Пожилова Е.В., Новиков В.Е., Гусева Е.С., Савченко А.В. Фальсифицированные лекарственные средства и борьба с ними в Российской Федерации. — 2020. — Т. 18. — № 1. — С. 63–70. https://doi.org/10.7816/RCF18163-70
RU-MX-2300059